 科技企业知识转化平台
科技企业知识转化平台
一种同时检测猕猴桃果酒中34种羰基化合物的方法-9479威尼斯
更新时间:2024-08-01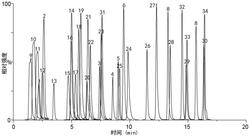 类型:发明专利;
类型:发明专利;地区:贵州-贵阳;
源自:贵阳高价值专利检索信息库;
专利名称:一种同时检测猕猴桃果酒中34种羰基化合物的方法
专利类型:发明专利
专利申请号:cn202211604660.1
专利申请(专利权)人:贵州大学
权利人地址:贵州省贵阳市花溪区
专利发明(设计)人:闫岩,李岑,邱树毅,周剑丽,曾祥勇,李豆南,敖红艳
专利摘要:本发明公开了一种同时检测猕猴桃果酒中34种羰基化合物的方法,属于酒类检测技术领域。本发明同时检测猕猴桃果酒中34种羰基化合物的方法,该方法是先采用衍生化试剂与羰基类化合物进行衍生化反应,然后再结合uplc‑ms/ms同时检测果酒中的挥发性酸类、不挥发酸类、挥发性醛类、不挥发醛类共34种羰基类化合物,且该方法的灵敏度高,检测限低,能够广泛应用于果酒中羰基类化合物高效灵敏的检测。
主权利要求:
1.一种同时检测猕猴桃果酒中34种羰基化合物的方法,其特征在于,所述方法包括如下步骤:(1)猕猴桃果酒衍生化处理
取猕猴桃果酒样品,先加入同位素内标丙酸‑d6溶液、苯乙酮‑d3溶液和壬醛‑d18溶液,再加入衍生化试剂3‑硝基苯肼盐酸盐溶液及催化剂n‑(3‑二甲氨基丙基)‑n'‑乙基碳二亚胺盐酸盐和吡啶,进行衍生化反应,反应结束后,过膜,即得待测液;
所述衍生化反应的体系为每40μl的猕猴桃果酒样品中分别加10μl浓度为500μg/l的内标溶液,丙酸‑d6溶液、苯乙酮‑d3溶液和壬醛‑d18溶液的浓度均为500μg/l,20μl浓度为200mmol/l的3‑硝基苯肼盐酸盐溶液,20μl浓度为120mmol/l的n‑(3‑二甲氨基丙基)‑n'‑乙基碳二亚胺盐酸盐溶液,其中含有6%的吡啶,再添加910μl的体积分数为50%乙腈水至1ml;
(2)标准曲线的建立
将34种羰基化合物混合溶解,配置成一系列浓度的标准溶液,并在标准溶液中加入同位素内标溶液和衍生化试剂及催化剂进行衍生化反应;反应结束后,采用uplc‑ms/ms测定,以每种羰基类化合物与相对应的同位素内标的峰面积比值作为纵坐标,每种羰基类化合物与相对应的同位素内标的浓度比值作为横坐标,构建定量关系模型;
所述uplc‑ms/ms检测的质谱条件:离子源为esi负离子模式,离子源温度110 120℃,~去溶剂温度500 550℃,毛细管电压2 3kv,碰撞电压13 30ev,锥孔电压为21 37v,锥孔~ ~ ~ ~气流50l/h,去溶剂气流800l/h;
所述uplc‑ms/ms检测的色谱条件:c18色谱柱100mm×2.1mm,1.7μm;柱温40℃;流动相a:水 5mmol/l乙酸铵 0.1%甲酸;b:乙腈/水95/5,v/v 5mmol/l乙酸铵 0.1%甲酸;流速
0.3ml/min;进样量10μl;梯度洗脱的程序为0‑1min,b18%,1‑11min,b45%,11‑15min,b
65%,15‑17,b100%,17‑19.5min,b100%,19.5‑20min,b18%,20‑23min,b18%;
其中34种羰基化合物包括酸类、醛类、酮类化合物;酸类化合物相对应的同位素内标物为丙酸‑d6;醛类化合物相对应的同位素内标物为壬醛‑d18;酮类化合物相对应的同位素内标物为苯乙酮‑d3;
(3)34种羰基化合物测定
将步骤(1)的待测液,采用uplc‑ms/ms进行检测,根据检测的待测液中各个化合物与相对应的同位素内标物的峰面积比值,并依据步骤(2)建立的定量关系模型,计算出猕猴桃果酒34种羰基化合物的含量。
2.根据权利要求1所述的方法,其特征在于,步骤(2)所述34种羰基化合物包括甲酸、乙酸、苯甲酸、2‑甲基丙酸、丁酸、己酸、辛酸、癸酸、苹果酸、dl‑对羟基苯基乳酸、2‑羟基‑4‑甲基戊酸、2‑糠酸、2,3‑二羟基丙酸、2‑羟基‑3‑甲基丁酸、3‑羟基丙酸、琥珀酸、乳酸、羟基乙酸、香草酸、丁香酸、咖啡酸、酒石酸、柠檬酸、3,4‑二羟基苯甲酸、糠醛、香兰素、苯甲醛、5‑甲基呋喃醛、己醛、乙醛、2,3‑丁二酮、3‑戊烯‑2‑酮、3‑戊酮、3‑羟基‑2‑丁酮。
3.根据权利要求1所述的方法,其特征在于,所述锥孔电压v、碰撞电压ev、定量母离子m/z和定量子离子m/z具体设置为:甲酸衍生物21/13/180.0/137.1,乙酸衍生物25/19/
194.0/137.1,苯甲酸衍生物33/17/256.1/150.1,2‑甲基丙酸衍生物33/19/222.1/137.1,丁酸衍生物33/19/222.1/137.1,己酸衍生物33/21/250.1/137.2,辛酸衍生物35/23/
278.2/137.1,癸酸衍生物37/27/306.2/137.1,2,3‑二羟基丙酸衍生物27/19/240.0/
136.9,羟基乙酸衍生物25/15/210.2/137.0,3‑羟基丙酸衍生物23/13/224.2/194.0,乳酸衍生物27/15/224.0/151.8,3,4‑二羟基苯甲酸衍生物31/29/288.2/108.2,2‑羟基‑3‑甲基丁酸衍生物31/17/252.2/151.9,酒石酸衍生物29/21/419.6/208.2,2‑糠酸衍生物25/17/
246.0/149.8,香草酸衍生物33/19/302.1/177.9,丁香酸衍生物35/25/332.2/150.0,苹果酸衍生物29/19/403.4/207.9,琥珀酸衍生物31/17/387.2/234.2,咖啡酸衍生物31/23/
314.2/176.0,2‑羟基‑4‑甲基戊酸衍生物31/17/266.2/151.8,dl‑对羟基‑苯基乳酸衍生物
31/17/300.0/151.8,柠檬酸衍生物35/30/596.3/222.2,乙醛衍生物21/15/177.9/137.0,香兰素衍生物29/21/286.1/148.0,糠醛衍生物25/17/230.0/137.0,5‑甲基呋喃醛衍生物
25/15/244.0/184.0,苯甲醛衍生物33/17/240.0/137.0,己醛衍生物27/19/234.0/136.9,
3‑羟基‑2‑丁酮衍生物23/15/221.8/137.0,3‑戊烯‑2‑酮衍生物23/19/218.0/137.0,3‑戊酮衍生物23/15/220.0/151.0,2,3‑丁二酮衍生物33/21/355.2/137.0,丙酸‑d6衍生物27/
19/213.2/137.2,苯乙酮‑d3衍生物29/17/257.0/154.0,壬醛‑d18衍生物33/23/294.3/
138.0。
4.由权利要求1 3任一所述的方法在酒类检测方面中的应用。
~ 说明书 : 一种同时检测猕猴桃果酒中34种羰基化合物的方法技术领域[0001] 本发明涉及一种同时检测猕猴桃果酒中34种羰基化合物的方法,属于酒类检测技术领域。背景技术[0002] 猕猴桃果酒中的羰基类化合物主要包括酸类、醛类、酮类化合物,对果酒的香气及口味有重要的影响,检测羰基化合物对评估猕猴桃果酒的风味品质、监控猕猴桃果酒的质量有重要意义。[0003] 目前果酒中的挥发性酸类、挥发性醛类、挥发性酮类化合物主要通过气相色谱直接检测,不挥发性酸类化合物主要采用液相色谱法或者衍生化后通过气相色谱检测,如果需一次性检测果酒中的羰基类化合物,需要采用气相色谱和液相色谱,或者通过气相色谱直接检测和衍生化后再检测的方式,方法繁琐费时,无法达到一次性检测的目的;并且灵敏度和准确度较低。[0004] 如现有技术,tang等人公开的“chemometricanalysisofchineseredwinesusingstirbarsorptiveextractioncombinedwithgc–msanalysis”葡萄酒中乙酸的检测限为618.50μg/l,2‑甲基丙酸的检测限为80.49μg/l,丁酸的检测限为80.08μg/l,苯甲醛的检测限为0.80μg/l;[0005] 王程成公开的“黄酒陈酿关键香气组分及其形成”中采用gc‑ms检测黄酒中乙酸的检测限为10.23μg/l,2‑甲基丙酸的检测限为5.11μg/l,丁酸的检测限为10.47μg/l,香兰素的检测限为5.11μg/l,苯甲醛的检测限为45.89μg/l,3‑羟基‑2‑丁酮的检测限为171.51μg/l。[0006] 王梦菡公开的“超高效液相色谱法测定不同香型白酒中乳酸和乙酸的含量”中uplc检测白酒中乳酸、乙酸的检测限均为1mg/l。[0007] du等人在“characterizationofkeyodorantsinlangyataibaijiuwithjianflavourbysensory‑directedanalysis”中公开的gc‑fid检测白酒中己酸检测限为1203μg/l,乙酸的检测限为6325μg/l,丁酸的检测限为8459μg/l,糠醛的检测限为891μg/l。[0008] 因此,急需开发一种灵敏高、检测限低的检测方法。发明内容[0009] [技术问题][0010] 现有技术酒类中的挥发性酸类、挥发性醛类、挥发性酮类化合物与不挥发性酸类化合物,无法实现一次性检测的效果,并且检测灵敏度低,难以批量操作。[0011] [技术方案][0012] 针对上述技术问题,本发明提供了一种同时检测猕猴桃果酒中34种羰基化合物的方法,该方法是采用衍生化试剂3‑硝基苯肼盐酸盐与挥发性酸类、不挥发酸类、挥发性醛类、不挥发醛类化合物在催化剂n‑(3‑二甲氨基丙基)‑n'‑乙基碳二亚胺盐酸盐和吡啶的作用下反应获得衍生化反应产物,通过超高效液相色谱‑串联质谱法(ultraperformanceliquidchromatography‑tandemmassspectrometry,uplc‑ms/ms)最终实现猕猴桃果酒中甲酸、乙酸、苯甲酸、2‑甲基丙酸、丁酸、己酸、辛酸、癸酸、苹果酸、dl‑对羟基苯基乳酸、2‑羟基‑4‑甲基戊酸、2‑糠酸、2,3‑二羟基丙酸、2‑羟基‑3‑甲基丁酸、3‑羟基丙酸、琥珀酸、乳酸、羟基乙酸、香草酸、丁香酸、咖啡酸、酒石酸、柠檬酸、3,4‑二羟基苯甲酸、糠醛、香兰素、苯甲醛、5‑甲基呋喃醛、己醛、乙醛、2,3‑丁二酮、3‑戊烯‑2‑酮、3‑戊酮、3‑羟基‑2‑丁酮共34种羰基类化合物高效、灵敏、准确的检测。[0013] 本发明的目的是提供一种同时检测猕猴桃果酒中34种羰基化合物的方法,所述方法包括如下步骤:[0014] (1)猕猴桃果酒衍生化处理[0015] 取猕猴桃果酒样品,先加入同位素内标丙酸‑d6溶液、苯乙酮‑d3溶液和壬醛‑d18溶液、再加入衍生化试剂及催化剂,进行衍生化反应,反应结束后,过膜,即得待测液;[0016] (2)标准曲线的建立[0017] 将34种羰基化合物混合溶解,配置成一系列浓度的标准溶液,并在标准溶液中加入同位素内标溶液和衍生化试剂及催化剂进行衍生化反应;反应结束后,采用uplc‑ms/ms测定,以每种羰基类化合物与相对应的同位素内标的峰面积比值作为纵坐标,每种羰基类化合物与相对应的同位素内标的浓度比值作为横坐标,构建定量关系模型;[0018] 其中34种羰基化合物包括酸类、醛类、酮类化合物;酸类化合物相对应的同位素内标物为丙酸‑d6;醛类化合物相对应的同位素内标物为壬醛‑d18;酮类化合物相对应的同位素内标物为苯乙酮‑d3;[0019] (3)34种羰基化合物测定[0020] 将步骤(1)的待测液,采用uplc‑ms/ms进行检测,根据检测的待测液中各个化合物与相对应的同位素内标物的峰面积比值,并依据步骤(2)建立的定量关系模型,计算出猕猴桃果酒34种羰基化合物的含量;[0021] 在一种实施方式中,步骤(1)所述丙酸‑d6溶液、苯乙酮‑d3溶液和壬醛‑d18溶液的浓度均为200~500μg/l。[0022] 在一种实施方式中,步骤(1)所述衍生化试剂为3‑硝基苯肼盐酸盐溶液。[0023] 在一种实施方式中,步骤(1)所述衍生化试剂的浓度为100~200mmol/l;就是将3‑硝基苯肼盐酸盐溶解于50%乙腈水溶液中配制而成。[0024] 在一种实施方式中,所述催化剂为n‑(3‑二甲氨基丙基)‑n'‑乙基碳二亚胺盐酸盐和吡啶。[0025] 在一种实施方式中,所述催化剂中n‑(3‑二甲氨基丙基)‑n'‑乙基碳二亚胺盐酸盐的浓度为100~120mmol/l,其中吡啶的质量占比为6%;催化剂的具体配置是将n‑(3‑二甲氨基丙基)‑n'‑乙基碳二亚胺盐酸盐和吡啶溶解于50%乙腈水溶液。[0026] 在一种实施方式中,步骤(1)所述衍生化反应的体系中,每40μl的猕猴桃果酒样品中分别加10μl浓度为500μg/l的内标溶液,20μl浓度为200mmol/l的3‑硝基苯肼盐酸盐溶液,20μl浓度为120mmol/l的n‑(3‑二甲氨基丙基)‑n'‑乙基碳二亚胺盐酸盐溶液(含6%吡啶),再添加910μl的体积分数为50%乙腈水至1ml。[0027] 在一种实施方式中,步骤(1)所述衍生化反应是在水浴温度为40~60℃条件下反应20~30min。[0028] 在一种实施方式中,步骤(2)所述34种羰基化合物包括甲酸、乙酸、苯甲酸、2‑甲基丙酸、丁酸、己酸、辛酸、癸酸、苹果酸、dl‑对羟基苯基乳酸、2‑羟基‑4‑甲基戊酸、2‑糠酸、2,3‑二羟基丙酸、2‑羟基‑3‑甲基丁酸、3‑羟基丙酸、琥珀酸、乳酸、羟基乙酸、香草酸、丁香酸、咖啡酸、酒石酸、柠檬酸、3,4‑二羟基苯甲酸、糠醛、香兰素、苯甲醛、5‑甲基呋喃醛、己醛、乙醛、2,3‑丁二酮、3‑戊烯‑2‑酮、3‑戊酮、3‑羟基‑2‑丁酮。[0029] 在一种实施方式中,步骤(2)所述uplc‑ms/ms检测的质谱条件:离子源为esi负离子模式,离子源温度110~120℃,去溶剂温度500~550℃,毛细管电压2~3kv,碰撞电压13~30ev,锥孔电压为21~37v,锥孔气流50l/h,去溶剂气流800l/h。[0030] 在一种实施方式中,所述锥孔电压v、碰撞电压ev、定量母离子m/z和定量子离子m/z具体设置为:甲酸衍生物21/13/180.0/137.1,乙酸衍生物25/19/194.0/137.1,苯甲酸衍生物33/17/256.1/150.1,2‑甲基丙酸衍生物33/19/222.1/137.1,丁酸衍生物33/19/222.1/137.1,己酸衍生物33/21/250.1/137.2,辛酸衍生物35/23/278.2/137.1,癸酸衍生物37/27/306.2/137.1,2,3‑二羟基丙酸衍生物27/19/240.0/136.9,羟基乙酸衍生物25/15/210.2/137.0,3‑羟基丙酸衍生物23/13/224.2/194.0,乳酸衍生物27/15/224.0/151.8,3,4‑二羟基苯甲酸衍生物31/29/288.2/108.2,2‑羟基‑3‑甲基丁酸衍生物31/17/252.2/151.9,酒石酸衍生物29/21/419.6/208.2,2‑糠酸衍生物25/17/246.0/149.8,香草酸衍生物33/19/302.1/177.9,丁香酸衍生物35/25/332.2/150.0,苹果酸衍生物29/19/403.4/207.9,琥珀酸衍生物31/17/387.2/234.2,咖啡酸衍生物31/23/314.2/176.0,2‑羟基‑4‑甲基戊酸衍生物31/17/266.2/151.8,dl‑对羟基‑苯基乳酸衍生物31/17/300.0/151.8,柠檬酸衍生物35/30/596.3/222.2,乙醛衍生物21/15/177.9/137.0,香兰素衍生物29/21/286.1/148.0,糠醛衍生物25/17/230.0/137.0,5‑甲基呋喃醛衍生物25/15/244.0/184.0,苯甲醛衍生物33/17/240.0/137.0,己醛衍生物27/19/234.0/136.9,3‑羟基‑2‑丁酮衍生物23/15/221.8/137.0,3‑戊烯‑2‑酮衍生物23/19/218.0/137.0,3‑戊酮衍生物23/15/220.0/151.0,2,3‑丁二酮衍生物33/21/355.2/137.0,丙酸‑d6衍生物(内标)27/19/213.2/137.2,苯乙酮‑d3衍生物(内标)29/17/257.0/154.0,壬醛‑d18衍生物(内标)33/23/294.3/138.0。[0031] 在一种实施方式中,所述uplc‑ms/ms检测的色谱条件:c18色谱柱(100mm×2.1mm,1.7μm);柱温40℃;流动相a:水 5mmol/l乙酸铵 0.1%甲酸;b:乙腈/水(95/5,v/v) 5mmol/l乙酸铵 0.1%甲酸;流速0.3ml/min;进样量10μl;梯度洗脱。[0032] 在一种实施方式中,所述梯度洗脱的程序为0‑1min,b18%,1‑11min,b45%,11‑15min,b65%,15‑17,b100%,17‑19.5min,b100%,19.5‑20min,b18%,20‑23min,b18%。[0033] 本发明的第二个目的是提供一种由上述所述的方法在酒类检方面中的应用。[0034] [有益效果][0035] (1)本发明提供了一种便捷、高效,一次性检测猕猴桃果酒中挥发性酸类、不挥发酸类、挥发性醛类、不挥发醛类共34种羰基类化合物的方法。[0036] (2)采用3‑硝基苯肼盐酸盐在催化剂n‑(3‑二甲氨基丙基)‑n'‑乙基碳二亚胺盐酸盐溶液和吡啶的作用下与羰基类化合物反应,并通过液相色谱质谱的方式进行定量猕猴桃果酒中的含量,该方法的灵敏度高于现有文献中气相色谱‑质谱(gaschromatography‑massspectrometry,gc‑ms)、uplc方法检测酒类化合物中的羰基类化合物。附图说明[0037] 图1为对比例1甲酸衍生物质谱条件优化数据图;(a)为锥孔电压的优化,(b)为碰撞电压的优化,(c)为优化后的甲酸衍生物质谱碎片;[0038] 图2为对比例2不同衍生化温度下羰基化合物的峰面积图;(a)为乙酸,(b)为乳酸,(c)为糠醛;(d)2,3‑丁二酮;[0039] 图3为对比例3不同衍生化时间下羰基化合物的峰面积图;(a)为乙酸,(b)为乳酸,(c)为糠醛;(d)2,3‑丁二酮;[0040] 图4为对比例4中不同流动相检测羰基类化合物的峰面积图;乙酸(a)、乳酸(b)、糠醛(c)、2,3‑丁二酮(d);[0041] 图5为本发明34种羰基化合物衍生物液相色谱质谱多反应监测扫描模式质谱图。具体实施方式[0042] 本发明实施例1中涉及的34种羰基化合物分别为甲酸、乙酸、苯甲酸、2‑甲基丙酸、丁酸、己酸、辛酸、癸酸、苹果酸、dl‑对羟基苯基乳酸、2‑羟基‑4‑甲基戊酸、2‑糠酸、2,3‑二羟基丙酸、2‑羟基‑3‑甲基丁酸、3‑羟基丙酸、琥珀酸、乳酸、羟基乙酸、香草酸、丁香酸、咖啡酸、酒石酸、柠檬酸、3,4‑二羟基苯甲酸、糠醛、香兰素、苯甲醛、5‑甲基呋喃醛、己醛、乙醛、2,3‑丁二酮、3‑戊烯‑2‑酮、3‑戊酮、3‑羟基‑2‑丁酮;其中,甲酸、乙酸、丁酸、己酸、辛酸、癸酸、苹果酸、2‑糠酸、琥珀酸、羟基乙酸、糠醛、苯甲醛、5‑甲基呋喃醛、己醛、2,3‑丁二酮、3‑戊酮、3‑羟基‑2‑丁酮、苯乙酮‑d3均购买于北京百灵威科技有限公司;[0043] dl‑对羟基苯基乳酸、乳酸、香草酸、丁香酸、咖啡酸、酒石酸、柠檬酸、香兰素、乙醛、丙酸‑d6购买于西格玛奥德里奇(上海)贸易有限公司;[0044] 苯甲酸、2‑甲基丙酸、2‑羟基‑3‑甲基丁酸、3,4‑二羟基苯甲酸、壬醛‑d18购买于梯希爱(上海)化成工业发展有限公司;[0045] 3‑羟基丙酸、3‑戊烯‑2‑酮购买于上海麦克林生化科技股份有限公司;[0046] 2,3‑二羟基丙酸购买于海相辉医药科技有限公司;2‑羟基‑4‑甲基戊酸购买于阿法埃莎(中国)化学有限公司,所有标准品的纯度高于95%。[0047] 实施例1[0048] 一种同时检测猕猴桃果酒中34种羰基化合物的方法,所述方法具体包括如下步骤:[0049] (1)猕猴桃果酒衍生化处理[0050] 取40μl猕猴桃果酒样品,分别加入10μl同位素内标溶液(丙酸‑d6、苯乙酮‑d3和壬醛‑d18,浓度均为500μg/l,溶解于50%vol乙醇水溶液中),加入20μl的200mmol/l浓度的3‑硝基苯肼盐酸盐溶液(溶解于体积分数为50%乙腈水溶液),再加入120mmol/l浓度的20μln‑(3‑二甲氨基丙基)‑n'‑乙基碳二亚胺盐酸盐溶液(含6%的吡啶,溶解于50%乙腈水溶液),涡旋振荡混匀,水浴40℃的条件下加热30分钟,水浴加热结束后恢复到室温,添加910μl的体积分数为50%乙腈水至1ml,过有机滤膜(0.22μm)后,备用。[0051] (2)标准曲线的建立[0052] 将34种羰基类化合物溶解在体积分数为10%的乙醇水溶液中,配置成一些列浓度(甲酸、乙酸、琥珀酸、糠醛为:250、500、1000、2000、4000、8000、16000;苯甲酸、2‑甲基丙酸、丁酸、己酸、辛酸、癸酸、羟基乙酸、3‑羟基丙酸、3,4‑二羟基苯甲酸、2‑羟基‑3‑甲基丁酸、酒石酸、2‑糠酸、香草酸、丁香酸、咖啡酸、2‑羟基‑4‑甲基戊酸、dl‑对羟基‑苯基乳酸、香兰素、5‑甲基呋喃醛、苯甲醛、己醛、3‑戊烯‑2‑酮、3‑戊酮、2,3‑丁二酮为:5、10、20、40、80、160、320;2,3‑二羟基丙酸、乙醛为:20、40、80、160、320、640、1280;乳酸、苹果酸、柠檬酸为:1250、2500、5000、10000、20000、40000、80000;3‑羟基‑2‑丁酮为:500、1000、2000、4000、8000、16000、32000;浓度单位均为μg/l),然后取各个浓度的溶液40μl分别置于0.5ml离心管中,加入10μl同位素内标溶液(丙酸‑d6、苯乙酮‑d3、壬醛‑d18),之后加入20μl的200mmol/l浓度的3‑硝基苯肼盐酸盐溶液(溶解于体积分数为50%乙腈水溶液),再加入120mmol/l浓度的20μln‑(3‑二甲氨基丙基)‑n'‑乙基碳二亚胺盐酸盐溶液(含6%的吡啶,溶解于50%乙腈水溶液),涡旋振荡混匀,水浴40℃的条件下加热30分钟,进行衍生化处理,反应结束后,再添加910μl的体积分数为50%乙腈水至1ml,进行uplc‑ms/ms测定,将羰基类化合物与相应的同位素内标物的峰面积比值作为纵坐标,羰基类化合物与相应同位素内标物的浓度比值作为横坐标,分别构建每种化合物的定量关系模型,结果如表2所示;[0053] 其中34种羰基化合物包括酸类、醛类、酮类化合物;酸类化合物相对应的同位素内标物为丙酸‑d6溶液;醛类化合物相对应的同位素内标物为壬醛‑d18溶液;酮类化合物相对应的同位素内标物为苯乙酮‑d3溶液;[0054] 采用多反应监测扫描模式进行检测;质谱条件:离子源为esi负离子模式,离子源温度120℃,去溶剂温度500℃,毛细管电压,毛细管电压2kv,碰撞电压和锥孔电压如表1中记载的数据进行设置,锥孔气流50l/h,去溶剂气流800l/h;具体34种羰基化合物质谱检测条件如表1所示;[0055] 色谱条件:c18色谱柱(100mm×2.1mm,1.7μm);柱温40℃;流动相a:水 5mmol/l乙酸铵 0.1%甲酸;b:乙腈/水(95/5,v) 5mmol/l乙酸铵 0.1%甲酸;流速0.3ml/min;进样量10μl;梯度洗脱程序为0‑1min,b18%,1‑11min,b45%,11‑15min,b65%,15‑17,b100%,17‑19.5min,b100%,19.5‑20min,b18%,20‑23min,b18%。[0056] (3)34种羰基化合物测定[0057] 将步骤(1)衍生化后的果酒待测液,采用uplc‑ms/ms进行检测,得到34种羰基类化合物与内标的峰面积比值,并依据步骤(2)建立的标准曲线模型,计算出猕猴桃果酒34种羰基化合物的含量。[0058] 表1.猕猴桃果酒中34种羰基类化合物的质谱检测条件[0059][0060][0061] 结果测定[0062] 1、标准曲线和精密度测定[0063] 34种羰基类化合物的线性回归方程如表2所示,相关系数均大于0.99,日间精密度为1.9%~6.9%,日内精密度为4.6%~9.2%,符合国家标准《实验室质量控制规范食品理化检测》(gb/t27404‑2008)有关校准曲线、精密度的要求。[0064] 表2.猕猴桃果酒中34种羰基类化合物的质谱检测条件[0065][0066][0067] 2、回收率测定[0068] 根据实施例1测定的34羰基类化合物的线性范围,选择34种羰基类化合物建立标准曲线范围的中间浓度添加于猕猴桃果中,并依据实施例1的检测方法,测定添加前后34种羰基类化合物含量的变化,计算回收率。[0069] 回收率=(添加后的浓度-添加前的浓度)/添加浓度×100%。[0070] 结果如表2所示;34种羰基类化合物的回收率均在85.4%~117.1%范围内,符合国家标准《实验室质量控制规范食品理化检测》(gb/t27404‑2008)有关回收率的要求。[0071] 3、实际样品测定结果[0072] 对猕猴桃果酒(12%vol)进行24种羰基化合物测定,均能够准确的定量检测,结果如表3所示:[0073] 表3猕猴桃果酒(12%vol)中34种羰基化合物的检测结果(平均值,mg/l±rsd)[0074] 序号 化合物 含量 序号 化合物 含量1 甲酸 6.02±2.56 18 丁香酸 0.007±1.942 乙酸 12.92±3.29 19 苹果酸 4.56±3.103 苯甲酸 0.009±1.37 20 琥珀酸 6.16±5.224 2‑甲基丙酸 0.011±3.09 21 咖啡酸 0.13±3.105 丁酸 0.013±0.87 22 2‑羟基‑4‑甲基戊酸 0.21±1.336 己酸 0.26±3.47 23 dl‑对羟基‑苯基乳酸 0.28±0.977 辛酸 0.22±0.95 24 柠檬酸 71.67±2.888 癸酸 0.006±1.06 25 乙醛 0.35±1.099 2,3‑二羟基丙酸 0.93±0.99 26 香兰素 0.25±1.4810 羟基乙酸 0.031±1.60 27 糠醛 1.87±0.9311 3‑羟基丙酸 0.11±0.88 28 5‑甲基呋喃醛 0.009±6.0112 乳酸 22.11±2.50 29 苯甲醛 0.075±1.0713 3,4‑二羟基苯甲酸 0.006±1.62 30 己醛 0.038±2.3314 2‑羟基‑3‑甲基丁酸 0.14±2.50 31 3‑羟基‑2‑丁酮 23.37±1.1515 酒石酸 0.012±1.11 32 3‑戊烯‑2‑酮 0.11±4.3116 2‑糠酸 0.008±2.08 33 3‑戊酮 0.061±1.8017 香草酸 0.13±4.41 34 2,3‑丁二酮 0.23±3.69[0075] 对比例1质谱条件优化[0076] 将浓度为1000μg/l的每个羰基化合物进行衍生化处理,最后稀释至2.5ml,置于液相小瓶中,通过质谱直接进样分析,流动相a为水,b为乙腈,流速为0.2ml/min;将质谱的锥孔电压设置为1~50v,碰撞电压设置成1~50ev,对34种羰基化合物获得衍生物的锥孔电压和碰撞电压进行了系统优化,得到丰度最高的子离子进行定量分析,丰度次高的离子进行辅助定性分析。[0077] 其中,以甲酸的质谱条件优化为例,结果如图1所示,甲酸经过3‑硝基苯肼盐酸盐衍生化后得到的衍生物在锥孔电压21v时有最高响应(图1a),因此确定锥孔电压为21v,当碰撞电压为13ev时,有最佳响应的特征碎片(图1b),此时,甲酸衍生物的质谱碎片如图1c,因此选择丰度最高的碎片137.1进行定量,丰度次高的碎片151.3进行辅助定性。[0078] 对比例2衍生化温度优化[0079] 在衍生化时间为20min的条件下,以水和乙腈为流动相,基于实施例1的质谱条件,分别以不同的反应温度30℃、40℃、50℃、60℃进行衍生化反应;并分别取代表性的挥发性酸、不挥发性酸、醛和酮化合物中的乙酸(1000μg/l)、乳酸(800μg/l)、糠醛(800μg/l)和2,3‑丁二酮(600μg/l)进行检测。[0080] 结果如图2所示,乳酸、糠醛和2,3‑丁二酮均是在40℃有最高的峰面积,甲酸在40℃峰面积较高,且与50℃条件下的峰面积并无显著差异,因此衍生化的温度确定为40℃。[0081] 对比例3衍生化时间优化[0082] 在衍生化温为40℃的条件下,以水和乙腈为流动相,基于实施例1的质谱条件,分别以不同的衍生化时间20min、25min、30min、35min、40min制备衍生化产物;并分别取代表性的挥发性酸、不挥发性酸、醛和酮化合物中的乙酸(1000μg/l)、乳酸(800μg/l)、糠醛(800μg/l)和2,3‑丁二酮(600μg/l)。[0083] 结果如图3所示,乳酸、糠醛和2,3‑丁二酮均是在30min有最高或者较高的峰面积,因此衍生化的温度确定为30min。[0084] 对比例4流动相条件优化[0085] 分别取代表性的酸、醛和酮化合物中的乙酸(800μg/l)、乳酸(400μg/l)、糠醛(400μg/l)和2,3‑丁二酮(400μg/l);在实施例1的基础上,调整流动相分别为:①a水、b乙腈;②a水 0.1%甲酸、b乙腈 0.1%甲酸;③a水 0.5%甲酸、b乙腈 0.5%甲酸;④a水 1mmol/l乙酸铵、b乙腈 1mmol/l乙酸铵;⑤a水 5mmol/l乙酸铵、b乙腈/水(95/5,v/v) 5mmol/l乙酸铵;⑥a水 5mmol/l乙酸铵 0.5%甲酸、b乙腈/水(95/5,v/v) 5mmol/l乙酸铵 0.5%甲酸;⑦a水 5mmol/l乙酸铵 0.1%甲酸、b乙腈/水(95/5,v/v) 5mmol/l乙酸铵 0.1%甲酸;分别进行检测。[0086] 结果如图4所示,从图中可以看出四种化合物均在流动相为⑦的条件下有最高的响应强度,因此流动相的选择a相:水 5mmol/l乙酸铵 0.1%甲酸;b相:乙腈/水(95/5,v/v) 5mmol/l乙酸铵 0.1%甲酸。[0087] 虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
专利地区:贵州
专利申请日期:2022-12-13
专利公开日期:2024-07-09
专利公告号:cn115856169b
以上信息来自国家知识产权局,如信息有误请联系我方更正!

