 科技企业知识转化平台
科技企业知识转化平台
soat1蛋白靶向抑制剂及应用发明专利-9479威尼斯
更新时间:2024-08-01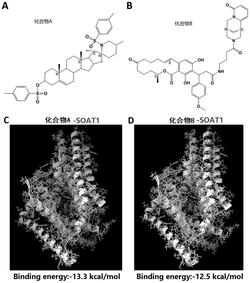 类型:发明专利;
类型:发明专利;地区:陕西-西安;
源自:西安高价值专利检索信息库;
专利名称:soat1蛋白靶向抑制剂及应用
专利类型:发明专利
专利申请号:cn202211484510.1
专利申请(专利权)人:陕西省中医药研究院
权利人地址:陕西省西安市莲湖区西华门2号
专利发明(设计)人:刘雨溪,张红,李晔,刘洋,陈志永
专利摘要:本发明公开了soat1蛋白靶向抑制剂及应用,属于医药技术领域。所述抑制剂包括包括化合物a或/和化合物b,包括化合物a或/和化合物b,所述的soat1蛋白靶向抑制剂在制备预防和治疗肝癌药物中的应用。本发明发现化合物a和化合物b对soat1蛋白高表达的hep3b和plc/prf/5肝癌细胞活力的抑制作用显著。此外,这两个化合物还能抑制肝癌细胞迁移及克隆形成,并降低肝癌细胞中soat1蛋白表达。在soat1沉默的肝癌细胞中,两个化合物对肝癌细胞活力的抑制作用均显著减弱。因此,化合物a和化合物b在细胞水平上能通过抑制soat1蛋白表达发挥抗肝癌作用,可应用于制备预防和治疗肝癌药物中。
主权利要求:
1.soat1蛋白靶向抑制剂在制备预防和治疗肝癌药物中的应用,所述soat1蛋白靶向抑制剂包括化合物b,化合物b的结构式为:
2.如权利要求1所述的应用,soat1蛋白靶向抑制剂抑制肝癌细胞活力。
3.如权利要求1所述的应用,soat1蛋白靶向抑制剂抑制肝癌细胞迁移和克隆。
4.根据权利要求2或3所述的应用,其特征在于,所述的肝癌细胞为hep3b或plc/prf/5。
5.根据权利要求4所述的应用,其特征在于:化合物b对肝癌细胞hep3b和plc/prf/5的ic50分别为4.246±0.594μm,6.245±0.613μm。 说明书 : soat1蛋白靶向抑制剂及应用技术领域[0001] 本发明属于医药技术领域,具体涉及soat1蛋白靶向抑制剂及应用。背景技术[0002] 肝癌是一种高发的,危害极大的疾病,全球每年新增确诊病例约90万。我国是肝癌大国,每年新发病例约40万。肝癌的常见治疗方案包括手术切除、肝移植、射频消融、化疗和靶向药物治疗等。手术或射频消融疗法适用于早期原位癌患者,然而大部分病人在疾病中晚期才被确诊,因此不适合手术或射频消融治疗。中、晚期肝癌治疗的原则是以化疗、靶向治疗等为主的综合治疗,但肝癌对于化疗的敏感性并不高,目前常用靶向药物包括仑伐替尼和索拉非尼等,但毒副作用和耐药性的发生限制了现有靶向药物的应用,亟需开发新型靶向药物治疗肝癌。[0003] 甾醇o‑酰基转移酶1(soat1)蛋白已被证明是肝癌特异性表达分子,肝癌组织中soat1蛋白的含量明显高于正常组织,是潜在的肝癌治疗新靶点。抑制soat1蛋白表达能有效抑制癌细胞的增殖和迁移能力,从而发挥抗肝癌作用,但目前针对该靶点的抑制剂研发尚不成熟。近年来,天然产物及其衍生物在抗肿瘤药物的开发中发挥着越来越重要的作用。为找到可能靶向到soat1蛋白的苗头化合物,本发明采用基于蛋白结构的虚拟筛选与体外实验验证相结合的研究策略,从天然产物中找到两个有显著抗肝癌效果的化合物,以期为新型soat1蛋白抑制剂的开发提供先导化合物。发明内容[0004] 本发明的目的在于克服现有技术的缺点,提供涉及soat1蛋白靶向抑制剂及应用。[0005] 本发明的目的通过以下技术方案来实现:soat1蛋白靶向抑制剂,所述抑制剂包括化合物a或/和化合物b,化合物a的结构式为:[0006][0007] 化合物b的结构式为:[0008][0009] 上述的soat1蛋白靶向抑制剂在制备预防和治疗肝癌药物中的应用。[0010] 上述的soat1蛋白靶向抑制剂在抑制肝癌细胞活力中的应用。[0011] 上述的soat1蛋白靶向抑制剂在抑制肝癌细胞迁移和克隆中的应用。[0012] 进一步地,所述的肝癌细胞为hep3b或plc/prf/5。[0013] 进一步地,化合物a对肝癌细胞hep3b和plc/prf/5的ic50分别为2.633±0.445μm,8.605±0.579μm;[0014] 化合物b对肝癌细胞hep3b和plc/prf/5的ic50分别为4.246±0.594μm,6.245±0.613μm。[0015] 本发明具有以下优点:本发明发现化合物a和化合物b对soat1蛋白高表达的hep3b和plc/prf/5肝癌细胞活力的抑制作用显著。此外,这两个化合物还能抑制肝癌细胞迁移及克隆形成,并降低肝癌细胞中soat1蛋白表达。在soat1沉默的肝癌细胞中,两个化合物对肝癌细胞活力的抑制作用均显著减弱。因此,化合物a和化合物b在细胞水平上能通过抑制soat1蛋白表达发挥抗肝癌作用,可应用于制备预防和治疗肝癌药物中。附图说明[0016] 图1为soat1三维结构及空腔及dockingbox的示意图,其中,a‑soat1三维结构及空腔;b‑dockingbox展示;边框为dockingbox,框中标记为6l47结构中的ci‑976。[0017] 图2为化合物a和化合物b的化学结构及与soat1蛋白的相互作用图,其中,a‑化合物a的化学结构式;b‑化合物b的化学结构式;c‑soat1蛋白与化合物a的相互作用图;d‑soat1蛋白与化合物b的相互作用图。[0018] 图3为化合物a和化合物b对细胞迁移的影响(n=3),其中,化合物a对a‑hep3b和c‑plc/prf/5细胞迁移的影响;化合物b对b‑hep3b和d‑plc/prf/5细胞迁移的影响;左侧为代表性图片,右侧为定量结果;*p<0.05与对照组相比。[0019] 图4为化合物a和化合物b对细胞克隆形成的影响(n=3),a‑化合物a和b‑化合物b对hep3b和c‑plc/prf/5细胞克隆形成的影响;左侧为代表性图片,右侧为定量结果;*p<0.05与对照组相比。[0020] 图5为化合物a和化合物b对soat1蛋白水平的影响(n=3),a‑化合物a及b‑化合物b对hep3b和plc/prf/5细胞soat1蛋白水平的影响;上侧为代表性印迹,下侧为定量结果;*p<0.05与对照组相比。ci‑976为阳性对照,在hep3b中浓度为20μm,在plc/prf/5中浓度为60μm。[0021] 图6为化合物a和化合物b对细胞活力的影响(n=3),a‑转染nc或soat1sirna后plc/prf/5细胞中soat1蛋白的表;左侧为代表性图片,右侧为定量结果;b‑化合物a和化合物b对soat1沉默的plc/prf/5细胞活力的影响;*p<0.05。具体实施方式[0022] 下面结合附图及实施例对本发明做进一步的描述,本发明的保护范围不局限于以下所述:[0023] 1材料和方法[0024] 1.1细胞[0025] 人肝癌细胞株hep3b和plc/prf/5购于atcc细胞库。[0026] 1.2试剂与仪器[0027] 化合物a(货号:stock1n‑11730),化合物b(货号:stock1n‑98880)纯度≥98%)购于interbioscreen;rpmi1640培养基(货号:11875101)、mem培养基(货号:41500034)、胎牛血清(货号:10099141c)均购于gibco公司;soat1抗体(货号:df7778)购于affinity;gapdh抗体(货号:ab181602)购于abcam;lipofectamine2000转染试剂购于thermofisher;soat1sirna2条soat1特异性sirna均由北京擎科生物科技有限公司合成,靶序列为:cucuucauguucuuuggaa。酶标仪(bioradimark),凝胶成像仪(bio‑radgeldocxr )。[0028] 1.3方法[0029] 1.3.1分子对接[0030] 从蛋白质数据库(proteindatabank,pdb)中下载soat1蛋白晶体结构复合物(pdbid:6l47)。经分析,如图1所示,发现soat1的一个与蛋白活性相关的大空腔适合虚拟筛选(图1中的a)。设定dockinggridboxcenter坐标为(85.6,97.1,109.6),dockinggridbox边长分别为25,25,25(6l47‑a.pse)(图1中的b)。据文献报道,soat1与其抑制剂ci‑976相互作用残基为:l377,y416,y417,w420,n421,v424,h460,主要依靠疏水相互作用进行结合。其中h460,n421,w420为活性位点。基于以上活性位点,通过蛋白质‑小分子配体的分子对接仿真软件autodockvina完成虚拟筛选,配体数据库(smiles格式)从interbioscreenltd.公司获得,按照dockingscore升序排列,ci‑976为阳性对照,以其与soat1对接分值为参照,筛选结合力强于ci‑976的化合物,并分析蛋白与配体之间的相互作用。[0031] 1.3.2细胞培养[0032] 肝癌细胞株hep3b和plc/prf/5购自美国atcc细胞库。hep3b细胞采用添加10%fbs的rpmi1640培养基进行培养,plc/prf/5细胞采用添加10%fbs的mem培养基进行培养。细胞培养条件为37℃,5%co2。[0033] 1.3.3半抑制浓度(ic50)检测[0034] 将处于对数生长期的hep3b和plc/prf/5细胞,以5,000个/孔的密度,分别接种于96孔板中。待贴壁后,分别加入化合物a或化合物b使其终浓度达到1.25、2.5、5、10、20μm,每组设6个复孔,每孔终体积为200μl,对照组加入等量含溶剂培养基。培养48h后,加入10μlcck8孵育4h,在450nm下测量吸光值。计算不同时间、不同浓度的化合物a和化合物b对hep3b和plc/prf/5细胞的ic50。ic50=[(对照组吸光度-实验组吸光度)/(对照组吸光度-空白组吸光度)]×100%。[0035] 1.3.4细胞划痕实验[0036] 将对数生长期的hep3b和plc/prf/5细胞以106个/孔的密度将细胞接种于6孔板中,待形成单细胞层后用无菌的10μl移液器吸头划过每孔中心,形成干净、笔直的划痕区域。pbs洗两次,去除脱落细胞,随后加入无血清含药培养基孵育24h。使用倒置显微镜在0h和24h随机选取5个视野对划痕拍照。使用以下公式计算细胞迁移率:(a‑b)/a×100%,其中a代表0h划痕宽度,b代表24h划痕宽度。[0037] 1.3.5结晶紫染色法测细胞克隆形成[0038] 将对数生长期的hep3b和plc/prf/5细胞按1,000个/孔的密度接种于6孔板中,24h后加入含药培养基,继续培养到第14天,中途每隔3天进行换液并观察细胞状态。克隆完成后,每孔加入1ml4%多聚甲醛固定30min,pbs洗1次,随后加入结晶紫染液1ml,染色20min,pbs洗3次,晾干后数码相机拍照。[0039] 1.3.6蛋白质免疫印迹实验[0040] 取对数期的hep3b和plc/prf/5细胞接种于60mm培养皿中培养24h,加药孵育48h后收集细胞并提取蛋白,高温变性后用sds‑page凝胶电泳分离,转入醋酸纤维素薄膜后封闭1h,4℃孵育一抗过夜,tbst洗膜后加入二抗孵育1h,tbst洗膜后加入显影液曝光,使用bio‑radgeldocxr 凝胶成像仪分析结果。使用imagej软件测定条带灰度值。[0041] 1.3.7sirna干扰[0042] 取对数期的plc/prf/5细胞接种于6孔板中,待细胞生长至70%~80%时,使用lipofectamine2000将soat1sirna或nc序列转染到细胞中,孵育48h。[0043] 1.3.8数据分析[0044] 采用graphpadprism8.0统计软件进行分析,实验数据表示为三次独立实验的平均值±标准差(mean±sd)。两组间的统计学差异采用t检验进行分析,多组间的差异采用单因素方差进行分析。p<0.05被认为差异具有统计学意义。[0045] 2结果[0046] 2.1分子对接筛选靶向soat1蛋白的天然产物[0047] 根据评分高低、化合物的骨架结构、作用力,从中选出化合物a和化合物b。选择soat1抑制剂ci‑976作为阳性对照。结合能结果见表1。[0048] 表1化合物a、化合物b与soat1蛋白的结合能[0049][0050][0051] 化合物a和化合物b的化学结构及与soat1蛋白的相互作用如图2所示,其中化合物a的化学结构式如图2中的a所示,其与soat1蛋白的互作图如图2中的c所示,主要通过氢键和疏水键结合,结合能为‑13.3kcal/mol。化合物b的化学结构式如图2中的b所示,其与soat1蛋白的互作图如图2中的d所示,主要结合方式为氢键和疏水键,结合能为‑12.5kcal/mol。与阳性对照ci‑976(‑7.0kcal/mol)相比,化合物a和化合物b与soat1的结合更强。[0052] 2.2化合物a和化合物b的ic50检测[0053] 从ccle数据库中查找到plc/prf/5及hep3b为soat1高表达的肝癌细胞系,并采用cck8法检测化合物a和化合b在这两种细胞上的ic50。结果如表2所示,化合物a在hep3b和plc/prf/5细胞上的ic50分别为:2.633±0.445μm,8.605±0.579μm;化合物b在hep3b和plc/prf/5细胞上的ic50分别为:4.246±0.594μm,6.245±0.613μm。化合物a和化合物b在两种细胞上的ic50均低于阳性对照ci‑976,差异有显著性。[0054] 表2化合物a和b的ic50(n=3)[0055]hep3b plc/prf/5化合物a 2.633±0.445μm 8.605±0.579μm化合物b 4.246±0.594μm 6.245±0.613μmci‑976 20.335±1.108μm 58.794±1.264μm[0056] 2.3化合物a和化合物b可抑制肝癌细胞迁移[0057] 划痕实验结果表明化合物a和化合物b对hep3b和plc/prf/5细胞迁移有抑制作用,结果如图3所示,给药组hep3b及plc/prf/5细胞的迁移率明显低于对照组,数据分析显示有统计学差异(p<0.05)。说明两种化合物均具有抑制细胞迁移的作用。[0058] 2.4化合物a和化合物b可抑制肝癌细胞克隆形成[0059] 化合物a和化合物b对hep3b和plc/prf/5细胞克隆形成的影响如图4所示,给药组的细胞克隆数明显少于对照组,数据分析显示有统计学差异(p<0.05)。这一结果与之前的发现一致,说明两种化合物均能够抑制细胞增殖和迁移。[0060] 2.5化合物a和化合物b对肝癌细胞中soat1蛋白水平的影响[0061] 采用免疫印迹法评价化合物a和化合物b对soat1蛋白的作用。结果如图5所示,免疫印迹结果及统计数据表明,化合物a和化合物b在plc/prf/5和hep3b细胞中均对soat1蛋白表达有剂量依赖型的抑制作用,作用效果与阳性对照ci‑976相似,且有效浓度更低。这一结果证明化合物a和化合物b在细胞水平上的抗肝癌作用可能与抑制soat1蛋白相关。[0062] 2.6沉默soat1可减弱化合物a和化合物b对肝癌细胞活力的影响[0063] plc/prf/5细胞系内soat1蛋白表达相对较高,通过细胞转染soat1sirna可敲低细胞内soat1表达。结果如图6中的a所示,与nc组比较,sirna显著下调plc/prf/5细胞内soat1蛋白水平,差异具有统计学意义(p<0.05)。同时,如图6中的b所示,在沉默soat1的细胞模型中,化合物a和化合物b抑制plc/prf/5细胞活力的作用被削弱,数据分析显示有统计学差异(p<0.05),以上结果证明抑制soat1是化合物a和化合物b发挥抗肝癌作用的机制。[0064] 以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都涵盖在本发明的保护范围之内。
专利地区:陕西
专利申请日期:2022-11-24
专利公开日期:2024-07-09
专利公告号:cn115710301b
以上信息来自国家知识产权局,如信息有误请联系我方更正!

