 科技企业知识转化平台
科技企业知识转化平台
短链异戊烯基转移酶活性检测方法发明专利-9479威尼斯
更新时间:2024-08-01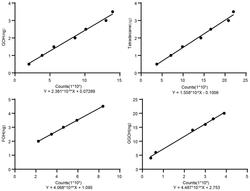 专利申请类型:发明专利;
专利申请类型:发明专利;地区:江苏-南京;
源自:南京高价值专利检索信息库;
专利名称:短链异戊烯基转移酶活性检测方法
专利类型:发明专利
专利申请号:cn202210742182.4
专利申请(专利权)人:南京大学,南京大学深圳研究院
权利人地址:江苏省南京市鼓楼区汉口路22号
专利发明(设计)人:卢山,宋书言,吕德新,唐倩
专利摘要:本发明公开了一种短链异戊烯基转移酶活性检测方法,包括以下步骤:步骤1,对短链异戊烯基转移酶重组蛋白进行体外表达与纯化;步骤2,建立短链异戊烯基转移酶反应体系;步骤3,加入碱性磷酸酶对短链异戊烯基转移酶的产物进行水解;步骤4,利用有机溶剂将溶于水相的异戊烯基醇类化合物萃取并浓缩;步骤5,对产物进行gc‑ms分析,实现对待测物的定性分析。本发明能够同时检测所有短链异戊烯基转移酶产物,可以在体外高效获取纯化的短链异戊烯基转移酶重组蛋白,实现了对相应产物的定性及定量分析。
主权利要求:
1.一种短链异戊烯基转移酶活性检测方法,其特征在于:包括以下步骤:步骤1,对短链异戊烯基转移酶重组蛋白进行体外表达与纯化;
利用生物信息学工具对短链异戊烯基转移酶的氨基酸序列进行信号肽预测,将去除n‑terminal信号肽的序列与pmal‑c5x载体中的mbp的orf进行融合构建,将目的蛋白进行体外表达与纯化;裂解buffer中加入苯甲磺酰氟pmsf、低温状态下进行超声裂解;
步骤2,建立短链异戊烯基转移酶反应体系;将短链异戊烯基转移酶与底物在反应缓冲液内共孵育;
步骤3,加入碱性磷酸酶对短链异戊烯基转移酶的产物进行水解;
步骤4,利用有机溶剂将溶于水相的异戊烯基醇类化合物萃取并浓缩;
加入正十四烷作为内参,混匀体系,水解产物用甲基叔丁基醚进行萃取,萃取产物进行氮吹浓缩,转移至玻璃衬管中准备进样;
步骤5,对产物进行gc‑ms分析,实现对待测物的定性分析;
利用梯度升温程序,分离不同的异戊烯基醇类化合物,结合质谱检测,对待测物的特征离子碎片峰进行分析,实现对待测物的定性分析;
依据最高丰度的特征离子峰进行标准曲线的绘制和定量分析。
2.根据权利要求1所述的短链异戊烯基转移酶活性检测方法,其特征在于:所述步骤2中,在短链异戊烯基转移酶反应体系中加入相应的蛋白,混匀体系,反应在30℃水浴进行,孵育时间为3小时。 说明书 : 短链异戊烯基转移酶活性检测方法技术领域[0001] 本发明属于基因工程技术领域,具体涉及短链异戊烯基转移酶的重组表达与体外活性检测及其相应产物的定性及定量分析。背景技术[0002] 萜类化合物是自然界中种类最多的天然化合物,目前已有超过43,333种萜类化合物被鉴定,它与人类生活紧密相关。其中,包括维生素a、维生素e、维生素k在内的萜类化合物为人类提供必要的营养物质。一些萜类化合物可用于化工业的生产,包括香叶醇、薄荷醇、月桂烯等单萜类化合物。萜类化合物也构成重要的药物资源库,如抗疟药青蒿素及抗癌药物紫杉醇。同时,萜类化合物也与植物的生理过程密不可分,如种子植物萌发过程中不可或缺的激素赤霉素、植物进行光合作用时依赖的捕光色素及电子传递链、植物果实成熟过程中产生的部分挥发性风味物质及胡萝卜素类化合物,都属于萜类化合物。[0003] 植物体内,萜类化合物前体都有相似的骨架结构,分别由不同催化特性的异戊烯基转移酶催化而来。其中,短链异戊烯基转移酶为许多重要的萜类化合物供应合成前体。例如催化牻牛儿基二磷酸(geranyldiphosphate,gpp)合成的牻牛儿基二磷酸合酶(gppsynthase,gpps),它在植物的质体中为单萜类化合物的合成提供底物,其下游产物在植物的授粉、防御、信号传递等过程中发挥重要作用。合成法尼基二磷酸(farnesyldiphosphate,fpp)的法尼烯二磷酸合酶(fppsynthase,fpps)位于多个代谢流分支节点处,它可用于倍半萜类化合物的合成,也可在胞质中参与蛋白质的异戊烯基修饰,两分子的fpp聚合形成甾醇等三萜类化合物的前体。牻牛儿基牻牛儿基二磷酸(geranylgeranyldiphosphate,ggpp)合酶(ggppsynthase,ggpps)与fpps相似,也供应多个下游代谢流的合成,包括叶绿素、胡萝卜素类化合物,赤霉素、脱落酸等植物激素。[0004] 对异戊烯基转移酶的研究,尤其是对其催化特性及效率的精准分析,具有非常重要的意义。有研究者通过合成生物学手段在大肠杆菌中引入β‑胡萝卜素合成相关的通路,用于ggpps活性的鉴定,可以检测目标蛋白是否具有体内合成ggpp的活性,然而无法确定目标蛋白产物的具体组成。同时这种体内检测方法也有其局限性,由于绝大多数生物体中含有fpp,这种利用合成生物学手段针对依赖fpp代谢流进行的合成通路设计路线并不适用于fpps的检测。发明内容[0005] 为了针对提高短链异戊烯基转移酶产物检测的广度和准确度,本发明的目的是提供一种短链异戊烯基转移酶活性检测方法,能够同时检测所有短链异戊烯基转移酶产物,可以在体外高效获取纯化的短链异戊烯基转移酶重组蛋白,以实现对相应产物的定性及定量分析。[0006] 为实现上述目的,本发明采用的技术方案为:[0007] 一种短链异戊烯基转移酶活性检测方法,包括以下步骤:[0008] 步骤1,对短链异戊烯基转移酶重组蛋白进行体外表达与纯化;[0009] 步骤2,建立短链异戊烯基转移酶反应体系;[0010] 步骤3,加入碱性磷酸酶对短链异戊烯基转移酶的产物进行水解;[0011] 步骤4,利用有机溶剂将溶于水相的异戊烯基醇类化合物萃取并浓缩;[0012] 步骤5,对产物进行gc‑ms分析,实现对待测物的定性分析。[0013] 所述步骤1中,利用生物信息学工具对短链异戊烯基转移酶的氨基酸序列进行信号肽预测,将去除n‑terminal信号肽的序列与pmal‑c5x载体中的mbp的orf进行融合构建,将目的蛋白进行体外表达与纯化。[0014] 所述步骤2中,将短链异戊烯基转移酶与底物在反应缓冲液内共孵育。[0015] 所述步骤2中,在短链异戊烯基转移酶反应体系中加入相应的蛋白,混匀体系,反应在33℃水浴进行,孵育时间为3小时。[0016] 所述步骤4中,加入正十四烷作为内参,混匀体系,水解产物用甲基叔丁基醚进行萃取,萃取产物进行氮吹浓缩,转移至玻璃衬管中准备进样。[0017] 所述步骤5中,利用梯度升温程序,分离不同的异戊烯基醇类化合物,结合质谱检测,对待测物的特征离子碎片峰进行分析,实现对待测物的定性分析。[0018] 有益效果:本发明相比现有技术,具有以下优点:[0019] 1.利用本法改进的蛋白纯化方式,去除目的蛋白潜在信号肽、与mbp标签融合表达可以提高蛋白的可溶性,裂解buffer中加入苯甲磺酰氟(pmsf)、低温状态下进行超声裂解可以保护蛋白的活性,用少量多次的洗脱方式可以成功收集高纯度的目的蛋白组分。该纯化方法可推广适用于植物各细胞器定位蛋白的体外纯化。[0020] 2.利用本法提供的体外短链异戊烯基转移酶活性检测方法,可以同时对目的蛋白的三种可能的短链异戊烯基二磷酸产物进行检测,包括牻牛儿基二磷酸、法尼烯基二磷酸、牻牛儿基牻牛儿基二磷酸。[0021] 3.通过本发明提供的针对短链异戊烯基醇类化合物的定量方法,引入正十四烷作为内参,用玻璃器皿收集萃取产物,降低塑料杂质的污染,依据最高丰度的特征离子峰进行标准曲线的绘制和定量分析,可以降低反应的检测限,提高定量的准确性。附图说明[0022] 图1为本发明中纯化获得的mbp标签的短链异戊烯基转移酶的sds‑page检测;[0023] 图2为本发明中短链异戊烯基转移酶产物的gc‑ms色谱图;[0024] 图3为牻牛儿醇的离子碎片峰图及谱库检索结果;[0025] 图4为法尼醇的离子碎片峰图及谱库检索结果;[0026] 图5为牻牛儿基牻牛儿醇的离子碎片峰图及谱库检索结果;[0027] 图6为牻牛儿醇、法尼醇、牻牛儿基牻牛儿醇的gc‑ms色谱图;[0028] 图7为依据积分峰面积绘制的内参、牻牛儿醇、法尼醇、牻牛儿基牻牛儿醇标准曲线。具体实施方式[0029] 下面结合附图和具体实施例,进一步阐明本发明,应理解这些实例仅用于说明本发明而不用于限制本发明的范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本申请所附权利要求所限定的范围。实施例[0030] (1)体外重组蛋白的诱导与纯化:[0031] 首先利用在线工具(https://services.healthtech.dtu.dk/service.php?targetp),对短链异戊烯基转移酶的氨基酸序列进行信号肽预测将去除n‑terminal信号肽的序列与pmal‑c5x载体中的mbp的orf进行融合构建。将该质粒转化到大肠杆菌rosetta2(de3)plyss表达菌株(novagen)。[0032] 大肠杆菌在含有羧苄青霉素(133mgl‑1)和氯霉素(34mgl‑1)的lb平板上进行筛选。挑取阳性克隆至相同抗性的lb液体培养基培养37℃摇床过夜培养至饱和,之后按照1:133转接至53ml相同抗性的lb液体培养基中,37℃摇床培养约3小时,至菌液od633数值至3.4‑3.6,之后加入3.4mmiptg在28℃诱导表达6小时。[0033] 8333g离心富集菌体,弃去上清,加入4ml吸附缓冲液(23mmtris‑hcl,ph7.4,233mmnacl,1mmedta)和1mmpmsf,将菌体充分重悬,并在低温状态下进行超声裂解,待菌液充分裂解至澄清,将破碎后的蛋白粗提液转入1.5ml离心管中,15333g在4℃离心33分钟,吸取上清液,使用amyloseresin(neb)进行蛋白纯化,具体步骤参考neb操作手册进行:上清液与amyloseresin在冰上共孵育13分钟,用12个柱体积单位的吸附缓冲液清洗,加入含有13mm麦芽糖(maltose)的洗脱缓冲液进行洗脱,每333μl收集为一个洗脱组分,一共收集12个洗脱组分,弃去低蛋白浓度组分,收集高蛋白浓度组分,合并混匀,用bradford法对纯化的目标重组蛋白进行浓度检测(bradford法蛋白质定量检测试剂盒,生工生物)。纯化效果如图1所示。[0034] (2)短链异戊烯基转移酶酶活实验[0035] 每个检测体系中加入5μg短链异戊烯基转移酶蛋白和433μl的含有底物的反应缓冲液。短链异戊烯基转移酶反应体系中含有ipp(233μm)和dmapp(133μm),反应buffer的配方为133mmhepes,5mmmgcl2,13mmkcl,1mmdtt,ph7.5,其中dtt在反应进行之前加入。在酶活体系中加入相应的蛋白,混匀体系,反应在33℃水浴进行,孵育时间为3小时。[0036] (3)短链异戊烯基转移酶产物的水解实验[0037] 在原体系中加入433μl水解buffer,含有23个活性单位的牛小肠碱性磷酸酶(5mg‑1 ‑1ml ,>13deaunitsmg ,sigma‑aldrich)的tris‑hcl(233mm,ph9.5)溶液,反应过夜。[0038] (4)产物的萃取[0039] 加入233ng的正十四烷(tetradecane,j&kchemical)作为内参,混匀体系,水解产物用533μl甲基叔丁基醚(methyltert‑butylether,mtbe)进行萃取,震荡混匀,15333g离心15分钟,小心吸取上层有机相,转移至样品瓶,再加入533μlmtbe重复萃取,萃取产物进行氮吹浓缩至53μl,转移至玻璃衬管中。[0040] (5)产物的gc‑ms分析[0041] 色谱条件为1μl不分流进样,使用安捷伦7893agc(agilent,santaclara,ca),配置色谱柱型号为hp‑5ms,质谱检测器为5977amsdetector(agilent)。初始温度45℃保持2分钟,13℃每分钟升温至253℃,保温5分钟。质谱与色谱端界面温度、离子源温度为283℃,调谐参数调用e.tune,定性检测时质谱检测器使用扫描模式(scanmode),记录63‑333m/z的碎片,短链异戊烯基转移酶产物的gc‑ms色谱图如图2所示。[0042] 牻牛儿醇的离子碎片峰及谱库检索结果如图3所示。法尼醇的离子碎片峰及谱库检索结果如图4所示。牻牛儿基牻牛儿醇的离子碎片峰及谱库检索结果如图5所示。牻牛儿醇、法尼醇、牻牛儿基牻牛儿醇的gc‑ms色谱图如图6所示。[0043] 定量检测时使用选择离子模式,记录85、93m/z的碎片,利用安捷伦masshunter分析软件对目标峰进行积分,统计积分峰面积,据积分峰绘制标准曲线如图7所示。[0044] 以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
专利地区:江苏
专利申请日期:2022-06-27
专利公开日期:2024-07-09
专利公告号:cn114934094b
以上信息来自国家知识产权局,如信息有误请联系我方更正!

